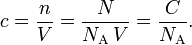***************************
1- مقارنة جسمين صلبين
نتوفر على جسمين أحدهما مكعب من ألومنيوم والثاني أسطوانة حديدية
…………………………….
1.1 . قياس الكتلة
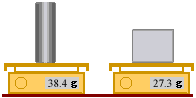
نقيس كتلة كل من المكعب والأسطوانة بميزان إلكتروني
كتلة الألومنيوم هي :
m(Al) = …g
كتلة الحديد هي :
m(Fe) = ….g
…………………………………
2.2. قياس الحجم
لقياس حجم جسم صلب يمكن استخدام إحدى الطريقتين التاليتين :
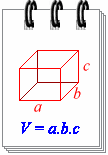
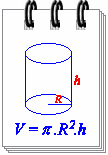
طريقة الحساب
تستخدم هذه الطريقة بالنسبة للأجسام ذات الأشكال الهندسية البسيطة، يمكن حساب الحجم بتطبيق القاعدة وذلك طبعا بعد قياس أبعاد الجسم..
طريقة إزاحة السائل
إذا لم نتمكن من تعيين الحجم بطريقة الحساب فيمكننا استعمال طريقة إزاحة السائل بتتبع المراحل التالية:
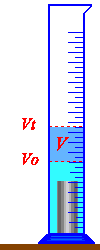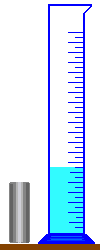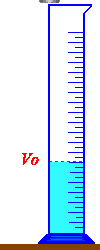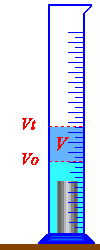
 نضع كمية من الماء في مخبار مدرج بحيث تكون هذه الكمية كافية لينغمر الجسم كليا في الماء.
نضع كمية من الماء في مخبار مدرج بحيث تكون هذه الكمية كافية لينغمر الجسم كليا في الماء.
 نقرأ قيمة التدريجة التي يقف عندها السطح الحر للسائل ونسجل قيمتها
نقرأ قيمة التدريجة التي يقف عندها السطح الحر للسائل ونسجل قيمتها
Vo = ….. ml
(1 ml =1 cm3)
 ندخل ببطء الجسم في المخبار لكي للكي نتجنب تطاير قطرات من الماء ..
ندخل ببطء الجسم في المخبار لكي للكي نتجنب تطاير قطرات من الماء ..
يمكن استعمال خيط دقيق نعلق فيه الجسم أو إمالة المخبار ووضع الجسم داخله لينزلق ببطء..
 نقرأ قيمة التدريجة التي يقف عندها السائل بعد إدخال الجسم ونسجل:
نقرأ قيمة التدريجة التي يقف عندها السائل بعد إدخال الجسم ونسجل:
Vt =…. ml
 الفرق بين القيمتين المسجلتين هو حجم الماء المزاح من طرف الجسم أي حجم الجسم وهو:
الفرق بين القيمتين المسجلتين هو حجم الماء المزاح من طرف الجسم أي حجم الجسم وهو:
V = Vt – Vo
النتيجة
حجم الحديد :
V =…. ml
حجم الألومنيوم
V =…. ml
……………………………………..
1.3. حساب الكتلة الحجمية
تعريف
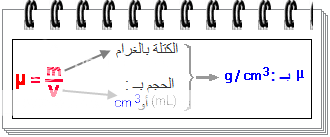
الكتة الحجمية هي وحدة الحجم، ونحصل عليها بقسمة كتلة كمية معينة من مادة ما على حجم نفس الكمية، ويرمز لها بالحرف µ
تميز الكتلة الحجمية الجسم وتمكن أيضا من مقارنة الأجسام بعضها ببعض..
ملحوظة
الوحدة العالمية للكتلة الحجمية هي kg/m3
أما الوحدة العملية فهي g/cm3
حساب الكتلة الحجمية
الكتلة الحجمية للحديد
µ =……g/cm3
الحجمية للألومنيوم
µ =…….g/cm3
………………………………………….. ………………………………………….. …………
يمكن مقارنة نتائج التجربة بالقيمتين المتداولتين للكتلة الحجمية لكل من الحديد والألومنيوم:
µ(Fe) ~ 7,8 g/cm3
µ(Al) ~ 2,7 g/cm3
………………………………………….. ………………………………………….. ………..
2- مقارنة سائلين
نواصل قياس الكتل والأحجام لكن الآن بالنسبة لسائلين هما الكحول والماء وذلك بتبع المراحل التالية:
العدة التجريبية
 ميزان الكتروني
ميزان الكتروني
 كأس
كأس
 ماء
ماء
 كحول الحريق
كحول الحريق
التجربة
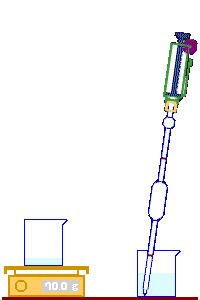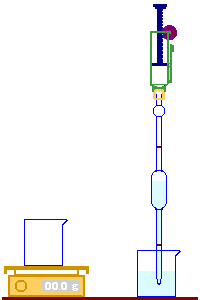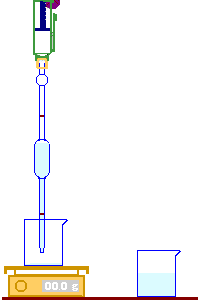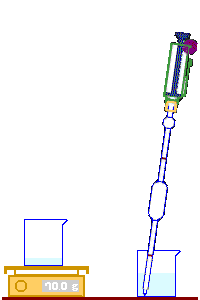
 نضع كأسا نظيفة وجافة على كفة الميزان ونضبط الميزان في الصفر ..
نضع كأسا نظيفة وجافة على كفة الميزان ونضبط الميزان في الصفر ..
 نملأ الماصة ، (Pipette) بالماء إلى أن يصل مستواه إلى الخط الموجود في الأعلى.
نملأ الماصة ، (Pipette) بالماء إلى أن يصل مستواه إلى الخط الموجود في الأعلى.
 يتم إفراغ الماصة في الكأس إلى أن يصل مستوى الماء إلى الخط الموجود في أسفلها.
يتم إفراغ الماصة في الكأس إلى أن يصل مستوى الماء إلى الخط الموجود في أسفلها.
يشير الميزان إلى الكتلة 10g وهي كتلة السائل المدروس ..
نتائج القياس
كتلة (10ml) من الماء هي :
m = ……g
كتلة (10ml) من الكحول هي :
m =……g
باستعمل العلاقة السابقة نحصل بسرعة على الكتلة الحجمية لكل من الماء والكحول.
الكتلة الحجمية للماء
µ =……g/cm3
الكتلة الحجمية للكحول
µ =……g/cm3
………………………………………….. ………………………………………….. …………………………
يمكن مقارنة هذه النتائج التجريبية بالقيم المتداولة لكل من الكحول والماء..
الكتلة الحجمية للماء في الظروف الاعتيادية :
ٍµo = 1,0 g/cm3
الكتلة الحجمية لكحول الحريق في الظروف الاعتادية :
µo = 0.8 g/cm3
مشكوور أخي معلومات قيمة
مشكور يا استاذ
شكرا لكنني اريد طريقة لحفظ قوانين المول
merci beaucoup

 pleeeeeeeeeeeeeeeeeeeeeeeeeease
pleeeeeeeeeeeeeeeeeeeeeeeeeease