درس المقادير المولية و كمية المادة للسنة أولى ثانوي
تعريف المول
المول هو وحدة قياس كمية المادة و يعني 10اس23.ضرب*6.023 فردا كيميائيا و رمزه mol
ملاحظة ..العدد n=6.023*10..23
هو عدد افوقادرو و هو عدد الذرات المحتواة في 12gمن الكربون c12
3/ الكتلة المولية
3-1/الكتلة المولية الذرية
الكتلة المولية الذرية لعنصر كيميائيxهي كتلة 1مول من ذرات هذا العنصر وحدتها g/molو رموزها mx
3-2/الكتلة المولية الجزيئية
هي كتلة واحد مول من جزيئات نوع كيميائي و تقدر بg/mol رمزها mاي الكتلة المولية للنوع الكيميائي ax byهي
m=xma+ymb
3-3/الحجم المولي
في الشرطين النظاميين من الضغط و درجة الحرارة اي 0c
p=1.013*10…6 pa اي 10اس 6
حجم 1 مول من جزيئات اي غاز يقدر ب22.4l لتر و يسمى الحجم المولي و رمزه mv
*
*
الكتلة المولية الذرية الوسطية
اذا كان العنصر مكون من عدة نظائر … اي العدد الكتلي مختلف a1/a2/a3
و نسبتها المئوية على التوالي xبالمئة /yبالمئة /zبالمئة
فان الكتلة المولية الذرية الوسطية لهذا العنصر تعطى بالعلاقة
mx=a1x/100+a2y/100+a3z/100…..
*
*
كثافة غاز بالنسبة للهواء
اذا كانت الكتلة المولية الجزيئية لغاز هي mفان كثافته بالنسبة للهواء تعطى تقريبا بالعلاقة
d=m/29
و هذه الصورة منقولة للافادة
.
.
.
.
..
.
.
.
.
.
.
.
.
ر 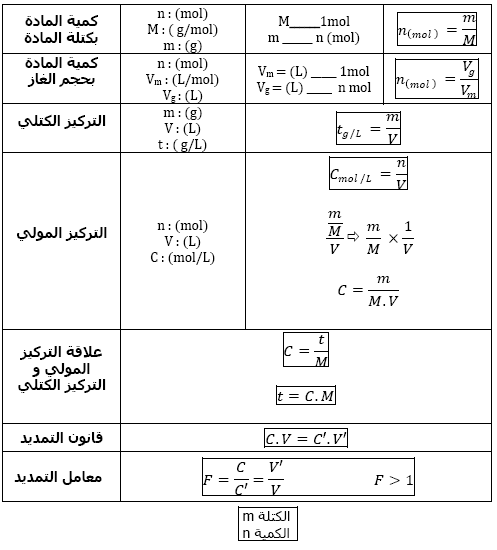
شكراااااااااااااا
مشكورة ربي يحفضك ويعاونك في قرايتتك كيما راكي تعاوني
شكرا
شكرااااااااااااا
chkoune hadiiiii
صاحبة الموضوع
boumadriya
والو بومرداية ممكن تجاوبيني
نعم شكرا تفضل اخي الكريم
ههههههههه مع ان سؤالك خارج موضوعي حول المقادير المولية و كمية المادة في قولك :
[وكأن اسمك يتكون من بومرداس وغرداية ممكن تشرحيهولي]
سوف اجاوبك بومرداية هو الاسم الذي الاختاره والدي عند تسجيله لي في هذا المنتدى و بومرداية هو اسم جد ابي بحيث انه كان مجاهدا ومحقق للاستقلال ………………….الخ
وانا فتحت هذا الموضوع حول الدراسة وليس من الاجل السخرية
انا فتحت هذا الموضوع حول الدراسة وليس من الاجل السخرية الالتزمو ا الاحترام ولا تبتعدو عن الموضوع
[center] الكتلة-الحجم- الضغط-كمية المادة
1-الكتلة الحجمية- الكثافة
الكتلة الحجمية لجسم كتلتهm و حجمه V هي µ=m/V
m ب kg و V ب m3 .
في الكيمياء نستعمل غالبا وحدات لا تنتمي ال وحدات النظام العالمي للوحدات
نكتب على سبيل المثال µeau=1000g/l نذكر L1000=1m3.
ملحوظة : تحويل وحدات الحجم
نعلم أنmm103 = 1m وm1cm =10-2
نستنتج أن 3mm109 =mm)3 103 ) = (1m)3
(1cm)3 = (10-2m )3 = 10-6 m3
2-كثافة صلب أو سائل
كثافة جسم صلب أو سائل بالنسبة للماء هي كتلة حجم من الجسم مقسومة على كتلة نفس الحجم من الماء d=µcorps/µeau وهي بدون وحدة.
قولنا كثافة الالومينيوم تساوي 2,7 يعني أن الالومينيوم أثقل 2,7 مرة من الماء.
ملحوظة :
في حالة الغاز الجسم المرجعي هو الهواء
d = µcorps/µair
باعتبارمول واحد من الهواء ومول واحد من الجسم نبين بكل سهولة d=M/29
M الكتلة المولية للجسم.
3- حساب كميات المادة
1-3حالة جسم خالص(صلب أو سائل أو غاز)
ادا كانت M الكتلة المولية للجسم و n كمية المادة للجسم
m كتلة الجسم الخالص فان m=n.M
2-3 حالة المذاب
اذا وجدت n مول من المذاب في محلول حجمه V . التركيز المولي الحجمي للمذاب C=n/V
كمية المادة للمذاب n=C.V .
نستعمل كذلك التركيز الكتلي تعبيره m/V= Cm
.وحدة C هي mol/L . وحدة Cm هي g/l.
نبين بسهولة أن Cm = C.M
3-3 حالة الغازات الكاملة
اذا اعتبرنا أن غازا يعتبر كاملا ، نعلم أن الضغط p وحدته (pa ) والحجم V وحدته (m3 )
كمية المادة n وحدتها (mol) ، ودرجة الحرارة T ب K(kelvin).
هذه المقادير مرتبطة بالعلاقة التالية : p.V=n.R.T
مع R=8,31J/(k.mol) تمثل ثابتة الغازات الكاملة. فنستنتج : n = p.V/R.T
يمكن اعتبار الغاز غازا كاملا اذا كان ضغطه ودرجة حرارته منخفضين.
ملحوظة
· يحول C°الى كيلفين K بواسطة العلاقة التالية : T(K)= t(°C)+273,15
· الحجم المولي هو الحجم الذي يشغله مول واحد من الغاز
اذا كان n=1mol فان V=Vm وبالتاليR.T = p.Vm فنستنتج :
نعتبر غازا حجمه V وحجمه المولي Vm . كمية مادته هي n = V/Vm
بحيث يتم قياسVوVm في نفس الشروط.
· الشروط النظامية
t =0,01°C يعني T = 273,16K وpa p =1,013.105
تطبيق
عندما نحسب الحجم المولي في الشروط النظامية نجد : L/mol 4 ,22 = Vm
تمرين(فرض منزلي)
-1 كثافة جسم صلب
كثافة الحديد هي d =7,8
· احسب كتلة مكعب من الحديد حرفه a = 20cm.
· احسب كمية مادة الذرات الموجودة في هذا المكعب.
الكتلة الحجمية للماء في شروط التجربة هيkg/m3 1000=µeau و M(Fe)=55,8g/mol
-2 تحضير محلول مائي لكيبرتات النحاس
تقني في المختبر يريد تحضير 500ml من محلول مائي لكبريتات النحاس II ذي تركيز c =0,01mol/l .
يوجد في المختبر كبريتات النحاس II الممية ذي الصيغةH2O) 5 , (CuSO4
ذكر بالخطوات التي سيتبعها التقني مع انجاز الحسابات اللازمة.
المعطيات : M(Cu)=63,5g/mol ; M(S)= 32 g/mol ; M(O)= 16g/mol ; M(H)=1g/mol
-3 التخفيف
من خلال محلول تجاري لحمض النتريك كثافته d=1,33 والنسبة المئوية للحمض في المحلول التجاري هي 52,5% نريد تحضير v = 1L من حمض النتريك بواسطة التخفيف ,ذي تركيز c2=0,1mol/l
1-3 احسب تركيز المحلول الأم.
2-3 حدد كيفية تحضير المحلول المخفف
المعطيات :
M(O)=16g/mol ;M(H)=1g/mol ;M(N)=14g/mol
µeau=1g/cm3
|
الاخت الكريمة & الوردة السوداء & انتهى الموضوع نحن نتحدث عن درس الفزياء لا تخرجي عن الموضوع انا لست من افرض القوانين ولاكن قانون المنتدى يمنع التعارف في منتديات الدراسة وشكرااا
نصيحة منني الاحترمي قوانين المنتدى انا لا اريد ان اضغط على |
|
أولا الأخت الكريمة أنا أعرف القوانين جيدا
ثانيا ++++++سألتها عن اسمها ليسهل التخاطب فقط ثالثا أعيدي قراءة القوانين يبدو أنك لا تعرفينها جيد ا ( ألتعلمين أن السب ممنوع بقولك حمقى ) |
|
شكرا لكي الاخت بومرداية لا تكترثي باقوال بعض الحمقى فنحن هنا للدراسة وليس للتعارف ةطرح الاسئلة سخيفة غير متعلقة بالموضووووووووع
|
هذا منتدى للتعليم
وقبل ان تعلم يجب ان نتخلق بالاخلاق الحميدة
ان نحسن لبعضنا البعض وان نتجاوز عن المخطئ بالكلمة الطيبة والنصيحة الحسنة
هذه المرة أعتبرها خطأ منكما في المرة القادمة سوف تعرضان انفسكم الى العقوبة
سبحان الله
شكرا جزيلاااااااااااااااااااااااااااااااااااااااااااااا لك أختاه والله صراحة أنا كنت خايفة من هذا الدرس و لكنك لخصتيه لنا بطريقة مثالية
شكرا لك والله ينجي بدنك من النار و كل المؤمنين ان شاء الله

