https://chimge.unil.ch/Fr/lc/1LC3.htm
L’expérience de William Crookes
En 1895, le Britannique William Crookes réalise une expérience importante sur les atomes.
Il utilise un tube en verre (aujourd’hui ce tube en verre est appelé tube de Crookes) dans lequel l’air est raréfié (la pression est faible, environ 1Pa).
Il place dans ce tube 2 électrodes, entre lesquelles il applique une tension d’environ 10 000 volts.
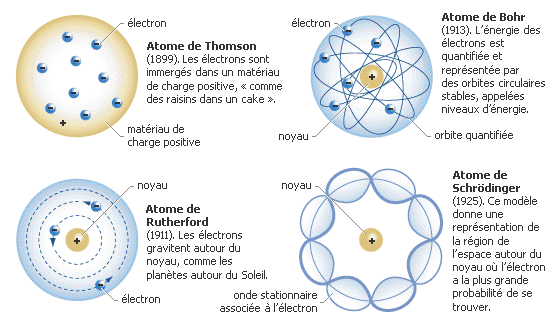
Il observe alors que pour une pression faible, un rayonnement issu de la cathode et provoquant une luminescence sur les parois du tube.
Il donne à ces rayonnements le nom de "rayonnements cathodiques".
Il montre que ces rayons sont électriquement chargés car ils sont déviés par le champ magnétiques d’un aimant.
En 1897, le Britannique Joseph John Thomson (1856-1940) prouve que ces "rayons cathodiques" sont des courants de particules portant une charge négative.
Dans le tube de Crookes, ces particules sont arrachés a la cathode.
Le modèle de l’atome de Rutherford
En 1909, la structure de l’atome reste dans le domaine des hypothèses.
Le physicien Britannique Ernest Rutherford (1871-1937) réalise une expérience décisive.
Il bombarde une feuille d’or très fine de particules alpha émises par un corps radioactif.
Les particules alpha sont des atomes d’hélium ayant perdu 2 électrons.
Elles sont beaucoup plus petites que les atomes d’or.
Rutherford considère que la feuille d’or est constituée d’environ 1 000 couches parallèles d’atomes.
Il observe que seule une infime minorité de particules alpha semble rebondir sur la feuille d’or : 1 sur 100 000.
La grande majorité de ces particules alpha ne sont pas déviés par la traversée de la feuille.
En 1910, il compare l’atome avec le système solaire ; l’atome est constitué d’un noyau autour duquel gravitent les électrons.
Le noyau est 104 à 105 fois plus petit que l’atome.
L’atome est constitué de beaucoup de vide et est électriquement neutre.
Il propose un modèle de l’atome (appelé "aspect lacunaire de l’atome")
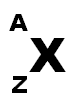
Points essentiels sur l’atome
Dimension :

Rayon atomique = 10-10m
Rayon noyau = 10-15m
Comparaison : Ra / Rn = 10-10 / 10-15 = 105
Les constituants de l’atome :
 noyau (les nucléons) :
noyau (les nucléons) :
– neutrons à électriquement neutre ; masse neutron = 1,675.10-27kg
– protons à chargés positivement ;
charge électrique : qe = e = 1,6.10-19 C (coulomb)
masse proton = 1,673.10-27 kg
(Donner la masse approché d’un atome veut dire que l’on ne prend pas en compte la masse des électrons qui est négligeable et qu’au lieu de prendre la masse des protons plus celle des neutrons, on prend la masse des nucléons (= 1,67.10-27kg)).
Ex : un atome qui a 56 nucléons : 56 × 1.67.10-27 = 9,352.10-26
Masse approché de l’atome = 9,352.10-26 kg
 électrons : masse électron = 9,1.10-31 kg
électrons : masse électron = 9,1.10-31 kg
qe = -e = -1,6.10-19
Composition de l’atome :
Représentation symbolique :

A = nombre de nucléons
Z = numéro atomique (nombre de charges, nombre de protons dans le noyau)
Nombre de neutrons = A – Z
Exemple :

18 nucléons, 8 protons, 10 neutrons et 8 électrons parce que l’atome est électriquement neutre donc il y a autant de protons (charge positive) que de d’électrons (charge négatives).
السلام عليكم ……..اريد دروس سنة اولىst باللغة العربية ارجوكم افيدوني
مشكووووووووورة حبيبتي على المجهود تسلمين
السلام ………مسيتكم بانوار النبي….لكن يا اختي نادية الدروس كلها بالفرنسية …بس من اجلك ارح ابحث انشاء الله عن قريق
سلام الى جميع الاعضاء اتشرف بنضمامي الى هذا المنتدى المتميز اريد انا ابلغ الانسة ناديا اني املك جميع دروس سنة اولى sse
st عربية ان كانت ماتزال تبحث عنها
aslam 3likm ana mzal nbht 3la dros b ararbe ya akhe nassim arjk afidni bihom marci
السلام عليكم يا اخت نادية أنا تاني طالب سنة أولى علوم المادة والتقنيات في أي جامعة تدرسين لأنني قد طلبت الدروس من صاحبي درس st العام الماضي ولكي نتعاون اكثر لتخطي السنة أولى
بارك الله فيك
السلام عليكم …….اولا شكرا لكوثانيا.اريد امتحانات جميع مقاييس سنة اولى علوم وتقنيات لاي جامعة جزائريةوشكرا
salam 3likom wallah madabik ya akhi tfidena ba derouss li anou imtihanaete 3ala abwab w ajrouka 3ala allah
merci……………..
thank youuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu uuu
بارك الله فيك
بارك الله فيك